Спирива Респимат, 2.5 мкг/доза, 60 доз, раствор для ингаляций, в комплекте с ингалятором Респимат, 4 мл, 1 шт.
| Действующее вещество | Тиотропия бромид |
| Производитель | Берингер |
| Страна | Германия |
| Торговое название | Спирива Респимат |
| Действующее вещество (МНН) | Тиотропия бромид |
| Дозировка или размер | 2.5 мкг/доза |
| Дозировка (доп. инфо.) | 60 доз |
| Форма выпуска | раствор для ингаляций |
| Форма выпуска (доп.инфо.) | в комплекте с ингалятором Респимат |
| Первичная упаковка | картридж |
| Объём упаковки | 4 мл |
| Количество в упаковке | 1 |
| Производитель | Boehringer Ingelheim |
| Страна | Германия |
| Срок годности | 3 года |
| Условия хранения | При температуре не выше 25 °C |
2.5 мкг/доза, 60 доз, раствор для ингаляций, в комплекте с ингалятором Респимат, 4 мл, 1 шт.
| Раствор для ингаляций | 1 доза |
| активное вещество: | |
| тиотропий | 2,5 мкг |
| соответствует тиотропия бромида моногидрату — 3,1235 мкг | |
| вспомогательные вещества: бензалкония хлорид — 1,105 мкг; динатрия эдетат — 1,105 мкг; хлористоводородная кислота 1М — до рН 2,8–3,0; вода — до 11,05 мг |
Прозрачный бесцветный или почти бесцветный раствор в картридже вместимостью 4,5 мл, помещенном в алюминиевый цилиндр.
Тиотропия бромид — антимускариновый препарат длительного действия, в клинической практике часто называемый м-холиноблокирующим средством. Препарат обладает одинаковым сродством к подтипам M1–M5 мускариновых рецепторов. Результатом ингибирования M3-рецепторов в дыхательных путях является расслабление гладкой мускулатуры.
Бронходилатирующий эффект зависит от дозы и сохраняется не менее 24 ч. Значительная продолжительность действия связана вероятно с очень медленной диссоциацией препарата от M3-рецепторов; период полудиссоциации существенно более длительный, чем у ипратропия бромида. При ингаляционном способе введения тиотропий бромид, как N-четвертичное производное аммония, оказывает местный избирательный эффект (на бронхи), при этом в терапевтических дозах не вызывает системных м-холиноблокирующих побочных эффектов. Диссоциация от M2-рецепторов происходит быстрее, чем от M3-рецепторов, что свидетельствует о преобладании селективности в отношении M3 подтипа рецепторов над M2-рецепторами. Высокое сродство к рецепторам и медленная диссоциация препарата из связи с рецепторами обусловливают выраженный и продолжительный бронходилатирующий эффект у пациентов с ХОБЛ.
Бронходилатация, развивающаяся после ингаляции тиотропия бромида, обусловлена в первую очередь местным (на дыхательные пути), а не системным действием.
В клинических исследованиях было показано, что применение препарата Спирива® Респимат® 1 раз в день приводит к значительному улучшению (по сравнению с плацебо) функции легких — ОФВ1 и форсированная жизненная емкость легких (ФЖЕЛ) в течение 30 мин после использования первой дозы. Улучшение функции легких сохраняется в течение 24 ч при Css.
Фармакодинамическое равновесие достигалось в течение одной недели. Спирива® Респимат® значительно улучшал утреннюю и вечернюю пиковую объемную скорость выдоха (ПОСВ), измеренную больными. Применение препарата Спирива® Респимат® приводило к уменьшению (по сравнению с плацебо) использования бронходилататора в качестве средства скорой помощи.
Бронходилатирующий эффект препарата сохраняется на протяжении 48 нед применения препарата; признаков привыкания не отмечается.
Анализ комбинированных данных двух рандомизированных плацебо-контролируемых, перекрестных клинических исследований показал, что бронходилатирующий эффект препарата Спирива® Респимат® (5 мкг) после 4-недельного периода лечения был в количественном отношении выше, чем эффект препарата Спирива® (18 мкг).
В долгосрочных (12-месячных) исследованиях было установлено, что Спирива® Респимат® значительно уменьшает одышку; улучшает качество жизни; снижает психосоциальное воздействие ХОБЛ и увеличивает активность.
Препарат Спирива® Респимат® достоверно улучшал общее состояние здоровья (общий балл) по сравнению с плацебо к концу двух 12-месячных исследований, это различие сохранялось на протяжении всего периода лечения; препарат Спирива® Респимат® значительно уменьшал число обострений ХОБЛ, и увеличивал период до момента первого обострения по сравнению с плацебо.
Доказано, что Спирива® Респимат® уменьшает риск обострения ХОБЛ и значительно снижает количество случаев госпитализации.
При ретроспективном анализе отдельных клинических исследований было замечено статистически недостоверное увеличение по сравнению с плацебо, количества случаев смерти у пациентов с нарушениями ритма сердца. Однако эти данные статистически не подтверждены и могут быть связаны с заболеванием сердца.
В клинических исследованиях у пациентов, страдающих бронхиальной астмой и продолжающих испытывать симптомы заболевания, несмотря на поддерживающую терапию ингаляционным кортикостероидом, в т.ч. в комбинации с длительно действующим агонистом бета2-адренорецепторов, было установлено, что добавление препарата Спирива® Респимат® к поддерживающей терапии приводило к достоверному улучшению функции легких по сравнению с плацебо, значительно уменьшало число серьезных обострений и периодов ухудшения симптомов бронхиальной астмы и увеличивало период до первого их наступления, приводило к достоверному улучшению качества жизни и увеличению числа пациентов с положительным ответом на поддерживающую терапию. Бронходилатирующий эффект препарата сохранялся на протяжении 1 года применения, признаков привыкания не отмечалось.
Тиотропия бромид — четвертичное производное аммония, умеренно растворимое в воде. Тиотропия бромид выпускается в виде раствора для ингаляций, который применяется с помощью ингалятора Респимат®. Приблизительно 40% от величины ингаляционной дозы осаждается в легких, остальное количество поступает в ЖКТ. Некоторые фармакокинетические данные, описанные ниже, были получены при использовании доз, превышающих рекомендуемые для лечения.
Всасывание. После ингаляции раствора молодыми здоровыми добровольцами установлено, что в системную циркуляцию поступает около 33% от величины ингаляционной дозы. Прием пищи не влияет на всасывание тиотропия бромида в связи с тем, что он плохо всасывается из ЖКТ. Абсолютная биодоступность при приеме внутрь составляет 2–3%. Cmax в плазме наблюдается через 5–7 мин после ингаляции. На стадии динамического равновесия пиковая концентрация тиотропия в плазме крови у пациентов с ХОБЛ составляет 10,5 пг/мл и быстро снижается. Это указывает на мультикомпартментный тип распределения препарата. На стадии динамического равновесия базальная концентрация тиотропия в плазме крови составляет 1,6 пг/мл. На стадии динамического равновесия пиковая концентрация тиотропия в плазме крови у пациентов с бронхиальной астмой составляла 5,15 пг/мл и достигалась через 5 мин.
Распределение. Связывание препарата с белками плазмы составляет 72%; Vd — 32 л/кг. Исследования показали, что тиотропия бромид не проникает через ГЭБ.
Биотрансформация. Степень биотрансформации незначительна. Это подтверждается тем, что после в/в введения препарата молодым здоровым добровольцам в моче обнаруживается 74% субстанции тиотропия бромида в неизмененном виде. Тиотропия бромид является эфиром, который расщепляется на этанол-N-метилскопин и дитиенилгликолиевую кислоту; эти соединения не связываются с мускариновыми рецепторами.
В исследованиях in vitro показано, что некоторая часть препарата (<20% от дозы после в/в введения) метаболизируется путем окисления цитохромом P450 с последующей конъюгацией с глютатионом и образованием различных метаболитов. Данный механизм может тормозиться ингибиторами изоферментов CYP450 2D6 и 3A4, хинидин, кетоконазол и гестоден. Таким образом, CYP450 2D6 и 3A4 участвуют в метаболизме препарата. Тиотропия бромид даже в сверхтерапевтических концентрациях не ингибирует цитохром P450 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 или 3A в микросомах печени человека.
Выведение. Терминальный T1/2 тиотропия бромида после ингаляции составляет от 27 до 45 ч у пациентов с ХОБЛ. У пациентов с астмой эффективный T1/2 после ингаляции составляет 34 ч.
Общий клиренс после в/в введения препарата молодым здоровым добровольцам составлял 880 мл/мин. Тиотропия бромид после в/в введения в основном выводится почками в неизмененном виде (74%). После ингаляции раствора у пациентов с ХОБЛ почечная экскреция составляет 18,6% (0,93 мкг), оставшаяся неабсорбировавшаяся часть выводится через кишечник. В стадии фармакокинетического равновесия у пациентов с астмой 11,9% (0,595 мкг) дозы выводится в неизмененном виде с мочой через 24 ч после приема препарата. Почечный клиренс тиотропия бромида превышает клиренс креатинина, что свидетельствует о его канальцевой секреции. После длительного ингаляционного приема препарата 1 раз в день пациентами с ХОБЛ фармакокинетическое равновесие достигается на 7-й день; при этом в дальнейшем не наблюдается аккумуляции.
Тиотропия бромид имеет линейную фармакокинетику в терапевтических пределах после в/в применения, ингаляции сухого порошка и ингаляции раствора.
Фармакокинетика пациентов пожилого возраста. В пожилом возрасте отмечается снижение почечного клиренса тиотропия (347 мл/мин у пациентов с ХОБЛ в возрасте до 65 лет и 275 мл/мин у пациентов с ХОБЛ и астмой старше 65 лет). Установлено, что у пациентов с бронхиальной астмой воздействие тиотропия бромида не зависит от возраста пациентов.
Пациенты с нарушениями функции почек. После ингаляционного применения тиотропия 1 раз в день в период устойчивого состояния фармакокинетики у пациентов с ХОБЛ и небольшими нарушениями функции почек (Cl креатинина 50–80 мл/мин) отмечалось небольшое увеличение величин AUC0–6,ss на 1,8–30% и Cmax,ss по сравнению с пациентами с нормальной функцией почек (Cl креатинина >80 мл/мин). У пациентов с ХОБЛ и умеренными или значительными нарушениями функции почек (Cl креатинина <50 мл/мин) в/в применение тиотропия бромида приводило к двукратному увеличению общего воздействия (AUC0–4 увеличивалась на 82%, а величина Cmax увеличилась на 52%) по сравнению с пациентами с ХОБЛ и нормальной функцией почек. Аналогичное повышение концентрации в плазме отмечалось и после ингаляции сухого порошка.
У пациентов с бронхиальной астмой и небольшими нарушениями функции почек (Cl креатинина 50–80 мл/мин) ингаляционное применение тиотропия бромида не приводило к значительному увеличению воздействия в сравнении с пациентами с нормальной функцией почек.
Пациенты с нарушениями функции печени. Предполагается, что печеночная недостаточность не оказывает значительного влияния на фармакокинетику тиотропия бромида, т.к. тиотропия бромид преимущественно выводится почками и с помощью неферментативного расщепления эфирной связи с образованием производных, которые не обладают фармакологической активностью.
поддерживающее лечение пациентов с ХОБЛ, хроническим бронхитом, эмфиземой легких; поддерживающая терапия при сохраняющейся одышке; улучшения качества жизни, нарушенного вследствие ХОБЛ, и снижение частоты обострений;
дополнительная поддерживающая терапия у пациентов с 6 лет с бронхиальной астмой, с сохраняющимися симптомами заболевания на фоне приема, по крайней мере, ингаляционных ГКС для уменьшения симптомов бронхиальной астмы, улучшения качества жизни и снижения частоты обострений.
Рекомендуемая терапевтическая доза составляет две ингаляции спрея из ингалятора Респимат® (5 мкг/терапевтическая доза) 1 раз в день, в одно и то же время суток (см. Инструкции по применению).
При лечении бронхиальной астмы полный терапевтический эффект наступает через несколько дней.
У пожилых пациентов, пациентов с нарушениями функции печени и пациентов с небольшими нарушениями функции почек (Cl креатинина 50–80 мл/мин) можно использовать препарат Спирива® Респимат® в рекомендуемой дозе.
Однако использование препарата у пациентов с умеренными или значительными нарушениями функции почек (Cl креатинина <50 мл/мин) должно тщательно мониторироваться.
ХОБЛ обычно не встречается у детей. Безопасность и эффективность препарата Спирива® Респимат® у детей до одного года не изучены.
Инструкция по применению
Следует прочитать эту инструкцию перед началом приемы препарата Спирива® Респимат®.

Внешний вид Спирива® Респимат®
Использовать этот ингалятор только 1 раз в день. Каждый раз при применении его следует делать 2 ингаляции.
Как хранить ингалятор Спирива® Респимат®
— в недоступном для детей месте;
— не замораживать;
— если ингалятор Спирива® Респимат® не использовался более 7 дней, направить его перед применением вниз и нажать 1 раз на кнопку подачи дозы;
— если ингалятор Спирива® Респимат® не использовался более 21 дня, повторить шаги 4–6 из Подготовка к первому использованию до появления облачка аэрозоля. Затем повторить шаги 4–6 еще 3 раза.
— не использовать ингалятор Спирива® Респимат® после окончания срока годности;
— не трогать прокалывающий элемент внутри прозрачной гильзы.
Как ухаживать за ингалятором Спирива® Респимат®
— очищать мундштук, включая металлическую часть мундштука, влажной тряпочкой или тканью, по меньшей мере 1 раз в неделю;
— любое незначительное изменение цвета мундштука не влияет на работу ингалятора Спирива® Респимат®.
Как определить, когда нужен новый ингалятор Спирива® Респимат®.
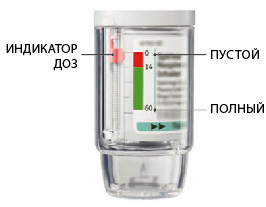
Ингалятор Спирива® Респимат® содержит 60 ингаляционных доз (т.е. 30 терапевтических доз) при условии применения в соответствии с указаниями (2 ингаляционные дозы 1 раз в день).
Индикатор доз показывает, сколько примерно доз еще осталось.
Когда индикатор доз покажет на красную область шкалы, это означает, что лекарства осталось примерно на 7 дней (14 ингаляционных доз).
Когда индикатор доз ингалятора достигнет конца красной шкалы, ингалятор Спирива® Респимат® автоматически заблокируется — больше не может быть получено ни одной ингаляционной дозы (поворот прозрачной гильзы будет невозможен).
Через 3 мес после первого использования Спирива® Респимат® следует выбросить, даже если он полностью не использован.
Подготовка к первому использованию
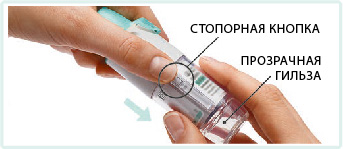
1. Снять прозрачную гильзу:
— держать колпачок закрытым;
— нажать стопорную кнопку и сильно потянуть при этом другой рукой за прозрачную гильзу.
2. Картридж: вставить узким концом в ингалятор; поставить ингалятор дном картриджа на твердую поверхность и сильно нажать на него, пока картридж не встанет на место со щелчком.
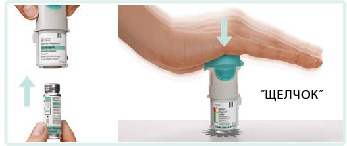
3. Установить на место прозрачную гильзу до щелчка.
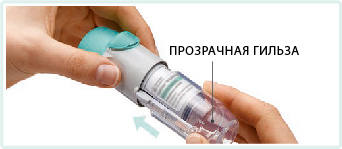
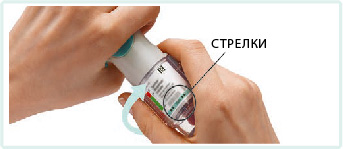
4. Повернуть прозрачную гильзу в направлении, указанном стрелками на этикетке, пока не раздастся щелчок (полоборота), держа колпачок закрытым.
5. Открыть колпачок до упора.

6. Нажать кнопку подачи дозы, предварительно направив ингалятор вниз; закрыть колпачок. Повторить шаги 4–6 до появления облачка аэрозоля, после появления которого повторить шаги 4–6 еще 3 раза.

Ежедневное применение
Повернуть прозрачную гильзу в направлении, указанном стрелками на этикетке, пока не раздастся щелчок (полоборота), держа колпачок закрытым.

Открыть колпачок до упора.

Сделать медленный полный выдох.
Обхватить мундштук губами, не перекрывая воздухозаборники.
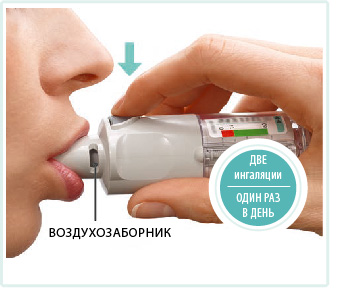
Делая медленный, глубокий вдох через рот, нажать кнопку подачи дозы и продолжать делать вдох.
Задержать дыхание примерно на 10 с или так долго, как пациент может.
Для получения второй ингаляционной дозы повторить: Повернуть, Открыть, Нажать.
Данные о влиянии препарата Спирива® Респимат® на беременность ограничены. В доклинических исследованиях при изучении репродуктивной токсичности не получено указаний на прямые или опосредованные неблагоприятные влияния препарата. В качестве меры предосторожности предпочтительнее воздержаться от использования препарата Спирива® Респимат® во время беременности.
Клинических данных о влияния тиотропия бромида у женщин, кормящих грудью, нет. Препарат не должен применяться у беременных или кормящих грудью женщин, если потенциальная польза для матери не превышает потенциальный риск для плода и ребенка. На период применения препарата необходимо прекратить кормление грудью ребенка.
Гиперчувствительность к любому компоненту этого препарата, атропину или его производным, например, ипратропию бромиду, окситропию бромиду.
С осторожностью: закрытоугольная глаукома, гиперплазия предстательной железы, обструкция шейки мочевого пузыря.
Многие из перечисленных ниже нежелательных реакций могут быть обусловлены м-холиноблокирующими свойствами препарата. Побочные реакции были выявлены на основании данных, полученных при проведении клинических исследований и отдельных сообщений в течение пострегистрационного использования препарата.
Частота побочных реакций, которые могут возникать во время терапии, приведена в виде следующей градации: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1 000, <1/100); редко (≥1/10 000, <1/1 000); очень редко (<1/10000); неуточненной частоты (частота не может быть оценена по доступным данным).
Со стороны обмена веществ и питания: неуточненной частоты — дегидратация.
Со стороны нервной системы: нечасто — головокружение; редко — бессонница.
Со стороны органа зрения: редко — повышение ВГД, глаукома; нечеткость зрения.
Со стороны ССС: редко — мерцательная аритмия; тахикардия (включая суправентрикулярную тахикардию), ощущение сердцебиения.
Со стороны органов дыхания, органов грудной клетки и средостения: нечасто — кашель, фарингит, дисфония; редко — носовое кровотечение, бронхоспазм, ларингит; неуточненной частоты — синусит.
Со стороны ЖКТ: часто — незначительная преходящая сухость слизистой оболочки глотки; нечасто — запор, кандидоз полости рта; редко — дисфагия, гастроэзофагеальный рефлюкс, гингивит, глоссит; неуточненной частоты — стоматит, кишечная непроходимость, включая паралитическую кишечную непроходимость.
Со стороны кожи и подкожных тканей: редко — кожные инфекции и язвы на коже, сухость кожи.
Аллергические реакции: нечасто — сыпь, зуд; редко — ангионевротический отек, крапивница; неуточненной частоты — гиперчувствительность, включая реакции немедленного типа.
Со стороны скелетно-мышечной системы и соединительной ткани: неуточненной частоты — припухлость суставов.
Со стороны почек и мочевыделительной системы: нечасто — дизурия, задержка мочи (чаще у мужчин с наличием предрасполагающих факторов); редко — инфекции мочевыводящих путей.
При применении высоких доз препарата возможны проявления м-холиноблокирующего действия.
После 14-дневного ингаляционного применения тиотропия бромида в дозах, достигавших 40 мкг, у здоровых лиц не наблюдалось значимых неблагоприятных явлений, кроме чувства сухости слизистых оболочек носа и ротоглотки, частота которых зависела от величины дозы (10–40 мкг в день). Исключение составляло отчетливое снижение саливации начиная с 7-го дня применения препарата. В 6 долгосрочных исследованиях у пациентов с ХОБЛ при ингаляционном применении раствора тиотропия бромида в суточной дозе 10 мкг в течение 4–48 нед не наблюдалось существенных нежелательных явлений.
Хотя специальных исследований лекарственных взаимодействий не проводилось, тиотропия бромид применялся совместно с другими препаратами для лечении ХОБЛ, включая симпатомиметические бронходилататоры, метилксантины, стероиды для приема внутрь и ингаляционного применения, антигистаминные препараты, муколитики, модификаторы ЛТ, кромоны, анти-IgE-препараты, при этом клинических признаков лекарственных взаимодействий не отмечалось.
Совместное применение с длительнодействующими бета2-агонистами, ингаляционными ГКС и их комбинациями не влияет на действие тиотропия.
Длительное совместное применение тиотропия бромида с другими м-холиноблокирующими препаратами не изучалось. Поэтому долгосрочное совместное применение препарата Спирива® Респимат® с другими м-холиноблокирующими препаратами не рекомендуется.
Препарат Спирива® Респимат® как бронходилататор, применяемый 1 раз в день для поддерживающего лечения, не должен применяться в качестве начальной терапии при острых приступах бронхоспазма или для устранения остро возникающих симптомов. В случае развития острого приступа используются быстродействующие β2-агонисты.
Препарат Спирива® Респимат® не должен использоваться для лечения бронхиальной астмы в качестве терапии первой линии. Пациентам следует рекомендовать на фоне приема препарата Спирива® Респимат® продолжать противовоспалительную терапию (например, ингаляционными ГКС), даже если симптомы уменьшатся.
После применения препарата могут развиваться немедленные реакции повышенной чувствительности.
Ингаляция препарата может вызывать бронхоспазм.
При умеренной или выраженной почечной недостаточности (Cl креатинина ≤50 мл/мин) прием препарата следует вести под тщательным наблюдением, как и при приеме всех лекарственных препаратов, экскретируемых преимущественно почками.
Пациенты должны быть ознакомлены с инструкцией по применению. Не следует допускать попадания раствора или аэрозоля в глаза. Боль или дискомфорт в глазах, нечеткое зрение, зрительные ореолы в сочетании с покраснением глаз, отек конъюнктивы и роговицы могут быть симптомами острой закрытоугольной глаукомы. При развитии любой комбинации этих симптомов следует немедленно обратиться к специалисту. Глазные капли, обладающие миотическим действием, не считаются эффективным лечением.
Препарат Спирива® Респимат® не должен использоваться чаще чем 1 раз в день. Картриджи препарата Спирива® должны использоваться только с ингалятором Респимат®.
Влияние препарата на способность управлять транспортными средствами и механизмами. Исследования по изучению влияния на способность управлять транспортными средствами и механизмами не проводились. Следует соблюдать осторожность при выполнении данных видов деятельности, т.к. возможно развитие головокружения или нечеткости зрения.
Раствор для ингаляций, 2,5 мкг/доза. Ингалятор Респимат® в комплекте с картриджем вместимостью 4,5 мл, помещенным в алюминиевый цилиндр. Ингалятор и цилиндр с картриджем помещают в картонную пачку.
По рецепту.
Берингер Ингельхайм Фарма ГмбХ и Ко.КГ. Бингер Штрассе, 173, 55216 Ингельхайм-на-Рейне, Германия.
Владелец регистрационного удостоверения. Берингер Ингельхайм Интернешнл ГмбХ, Бингер Штрассе, 173, 55216 Ингельхайм-на-Рейне, Германия.
Получить дополнительную информацию о препарате, а также направить свои претензии и информацию о нежелательных явлениях можно по следующему адресу в России. ООО «Берингер Ингельхайм». 125171, Москва, Ленинградское ш., 16А, стр. 3.
Тел: (495) 544-50-44; факс: (495) 544-56-20.